제넥신(095700) 사정에 대해 잘 아는 업계 전문가는 이렇게 말했다. 제넥신의 신약 사업화 일정이 지연되는 일이 잦기 때문에 이 같은 발언을 한 것으로 풀이된다.
◇"또 내년 이후?"…주요 파이프라인 일정 줄줄이 지연
제넥신이 지난달 말 주주간담회를 통해 공개한 R&D 현황과 계획을 살펴보면 이번에도 사업화 일정 지연 사례가 확인된다.
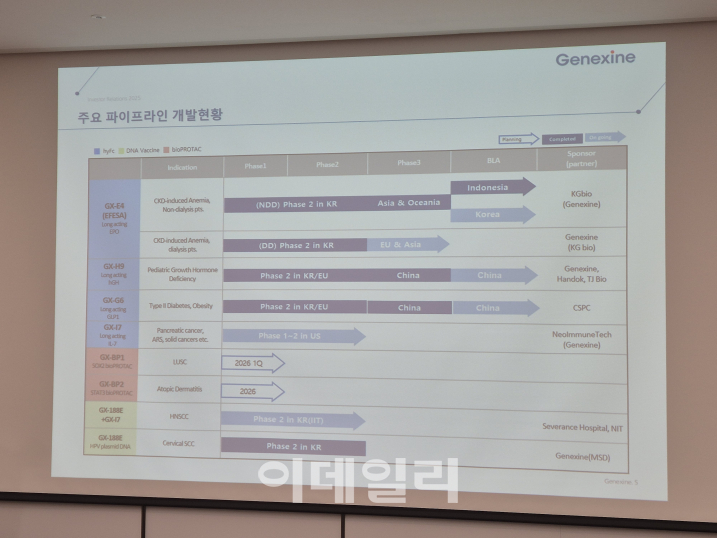
제넥신이 지난달 기업설명회에서 공개한 주요 파이프라인 개발 현황 (사진=김새미 기자)
빈혈 치료제 '에페사'(GX-E4)의 경우 올해 2분기로 예상됐던 국내 식약처 허가 예상 시점이 내년 2~3분기로 미뤄졌다. 올해로 예상됐던 성장호르몬 'GX-H9'의 중국 출시 시점은 내년으로 지연됐다. EPD바이오테라퓨틱스 합병으로 새로 확보한 바이오프로탁(BioPROTAC) 기반 파이프라인의 글로벌 기술이전 목표 시점도 2026년 상반기에서 2026년 내로 조정됐다.
이러한 제넥신의 사업화 일정 지연은 반복돼온 문제다. 제넥신은 거의 매년 각 파이프라인의 인허가나 출시 목표 시점을 수정했다. 같은해에도 상반기와 하반기의 타임라인이 바뀐 사례도 있다. 에페사의 인도네시아 품목허가가 2023년 10월 이뤄진 것은 제넥신에서 드물게 발표했던 일정에 맞춘 사례로 꼽힌다.
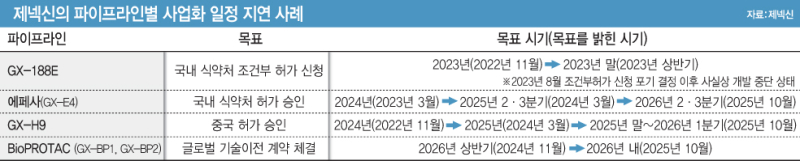
[그래픽=이데일리 김일환 기자]
앞서 제넥신은 2022년 11월까지만 해도 '상업화 1호 후보'로 자궁경부암 DNA 백신 'GX-188E'을 내세우다 4개월 만인 2023년 3월 에페사를 상용화 1호 후보로 바꿨다. 제넥신은 2023년 상반기만 해도 연말까지 GX-188E의 국내 식약처 조건부허가를 신청하겠다고 했으나 같은해 8월 이를 포기하기로 결정했다. 이후 GX-188E의 자궁경부암 치료제 개발은 사실상 중단됐다. 이와 관련, 홍성준 제넥신 경영 총괄 대표는 지난달 말 "임상 2상까지 수치적으로는 잘 완료됐는데 시기를 놓쳐서 경제성 측면에서 의문(question)이 생겼고, 일시 중지(holding)된 상태"라고 했다.
몇 년 전으로 거슬러 올라가면 제넥신의 상업화 1호 후보는 코로나19 DNA 백신 'GX-19'였다. 성영철 전 제넥신 회장은 2020년 코로나19 백신 개발에 출사표를 던지면서 "내년(2021년) 9월이면 우리가 개발한 국산 코로나19 백신을 갖게 될 것"이라고 자신했다. 그러나 제넥신은 같은해 12월 백신후보물질을 'GX-19'에서 'GX-19N'으로 변경해 임상 1상부터 다시 수행하게 됐다. 2022년 3월에는 엔데믹으로 인한 시장성 부족을 이유로 임상 2/3상을 자진 철회했다.
제넥신 투자자들이 에페사의 국내 식약처 허가 시점에 주목하는 이유는 상용화 매출 때문이다. 에페사는 2023년 10월 인도네시아 품목허가를 받고 2024년 4월 제품 출시됐고 지난 5월 캄보디아 생물학적제제 허가(BLA) 승인도 받았다. 하지만 제넥신이 이에 따른 수익을 기대할 순 없다. 에페사의 아시아 지역 시판에 따른 로열티를 제넥신이 수취할 수 없는 계약 구조이기 때문이다.
제넥신은 지난해 1월 식약처에 에페사 품목허가를 신청했다 같은해 11월 허가 신청을 자진취하했다 재신청했다. 제넥신은 최근 식약처로부터 보완서류 요청을 받았으며, 내달까지 보완서류를 제출할 예정이다. 회사는 내년 2~3분기에는 국내 식약처 허가를 받을 것으로 예상하고 있다. 이는 당초 예상했던 2025년 2분기보다 2~3분기 미뤄진 일정이다.
GX-H9의 중국 출시 예상 시점은 2024년에서 2025년으로 미뤄진 데 이어 지난달에는 2026년으로 지연됐다. 제넥신은 지난해 말 BLA 신청에 따라 올해 말~내년 초 승인을 예상하고 있다. 홍 대표는 "GX-H9는 중국 파트너사가 지난해 11월 중국 허가를 신청해 내년 1분기 승인을 기대하고 있다"고 언급했다. 이에 따라 GX-H9의 중국 출시도 빨라야 2026년에 가능할 것으로 예상된다.
◇중국 인허가 앞둔 'GX-G6'…"제넥신, 권리 주장 어려워"
비만치료제 붐이 일면서 새롭게 주목받은 비만·당뇨 치료제 'GX-G6'는 내년 중국 허가가 기대되는 상황이다. GX-G6는 2015년 중국 아이맵(현 TJ바이오)에 기술이전된 이후 CSPC로 재기술이전된 물질이다. CSPC는 2018년 해당 파이프라인을 도입한 뒤 중국 CSPC는 비당뇨성 비만 임상 3상을 마치고 인허가 절차에 진입했다. 해당 임상 3상은 완료됐으며, 이를 바탕으로 CSPC는 중국 품목허가를 신청했다.
단 GX-G6는 초기 단계에 CSPC로 중국 판권이 넘어갔기 때문에 제넥신이 권리를 주장하기 어려운 상황이다. 홍 대표는 "(GX-G6는) 초기 단계에서 CSPC 손에 들어가서 임상 3상을 하고 중국 허가를 신청한 것이기 때문에 제넥신이 권리를 주장할 수 있냐고 한다면 그건 좀 힘들다"며 "CSPC가 중국 판권만 갖고 있기 때문에 중국 외 판권에 대해선 우리와 논의해야 할 것"이라고 밝혔다.
CSPC는 GX-G6의 중국 외 지역 판매 논의에 미온적인 태도를 보이고 있다. 홍 대표는 "CSPC가 GX-G6 데이터를 제넥신에 공유할 의무가 없기 때문에 따로 받은 건 없다"며 "중국 외 지역 진출에 대해 논의를 타진하고 있지만 아직 CSPC가 적극적으로 얘기하고 있진 않다"고 전했다.
이처럼 제넥신의 사업화 일정이 잘 지켜지지 않는 이유는 뭘까? 업계에서는 제넥신의 인사 이동이 잦고 우선순위 변동이 빈번한 데에서 그 이유를 찾았다. 바이오업계 관계자는 "제넥신이 지금도 그렇고 예전에도 그렇고 인력의 턴오버(Turnover)가 잦아서 내부적으로 프로젝트 정리도 잘 안 되고 인수인계도 잘 안 될 것"이라며 "우선순위도 자주 바뀌다 보니 프로젝트 매니징(Project Managing)이 잘 안 된다"고 분석했다.
또 다른 업계 관계자는 "제넥신은 경영진도 완전히 바뀌었고, 기존 의사결정하던 사람들이나 임상개발하던 사람들이 모두 교체되면서 회사 전략 추진에 변동이 생겨서 그런 것 같다"며 "(기술이전 계약 구조 관련해선) 예전에는 제넥신이 연구개발비 부담이 크다보니 기술이전 시 (시판 후) 엄청난 대박이 나지 않는 한 수익을 기대하기 어려운 구조로 계약해서 당시에도 우려의 목소리가 많았다"고 답했다.
◇돌파구 될 바이오프로탁…2026년 내 기술수출 가능할까?
결국 제넥신의 핵심 모멘텀은 바이오프로탁 기반 파이프라인(GX-BP1, GX-BP2)의 기술수출이다. 지난해 말까지만 해도 2026년 상반기로 기대됐던 글로벌 기술이전 목표 시기는 최근 '2026년 내'로 조정됐다.
최재현 제넥신 R&D 총괄 대표는 지난해 11월 "2026년 상반기 글로벌사 기술수출 목표"라고 언급했으나 지난달에는 "빠르면 2026년 상반기 기술수출 계약을 예상한다"며 "늦어도 2026년 내 기술이전 계약을 1건 체결하는 것을 목표로 하고 있다"고 말을 바꿨다. 기술수출 목표 시점이 2026년 상반기에서 하반기로 연장된 셈이다.
제넥신은 내년 3월까지 GLP 독성시험(GLP-Tox) 결과를 확보해 글로벌사와 기술이전 논의를 본격화할 계획이다. 최 대표는 "내년 3월 정도면 GX-BP1의 로우데이터(Raw data)를 다 확보하게 되기 때문에 글로벌 기업들과 본격 논의가 시작될 것"이라며 "내년 6월까지, 늦어도 내년 안에는 의미 있는 기술이전 계약을 체결하도록 노력하겠다"고 강조했다.
일각에선 GX-BP1의 조기 기술이전이 녹록지 않을 것이란 전망도 나온다. 업계 관계자는 "제넥신의 바이오프로탁 기반 파이프라인은 타깃(SOX2)과 플랫폼 모두 새롭기 때문에 빅파마에선 리스크가 높다고 판단해 임상데이터를 요구할 가능성이 높다"며 "그런 면에서 조기 기술이전이 쉽지 않을 것"이라고 내다봤다.










