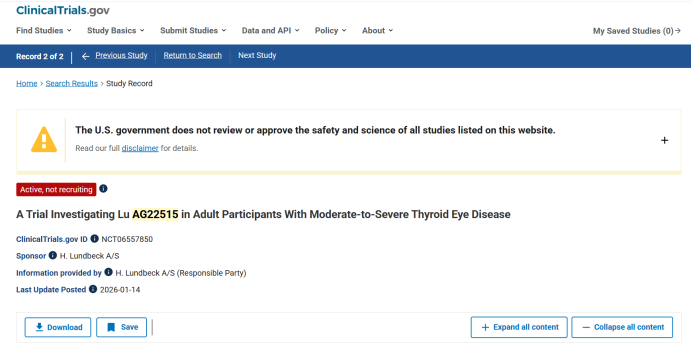
룬드벡은 지난 14일(현지시간) 'Lu AG22515'(APB-A1) 갑상선안병증(TED) 임상 1상의 환자 모집이 완료됐다고 업데이트했다.(자료=클리니컬트라이얼스(Clinical Trials))
20일 미국 국립보건원(NIH)의 클리니컬트라이얼스(Clinical Trials)에 따르면 룬드벡은 지난 14일(현지시간) 'Lu AG22515'(APB-A1) 임상 1상의 환자 모집이 완료됐다고 업데이트했다.
해당 임상은 중등~중증 갑상선안병증(TED) 환자 20명을 대상으로 진행됐으며, 주요 평가지표는 24주 안구돌출 변화와 PK, 면역원성 등이다. 환자 모집이 완료되면서 임상의 1차 종료(Primary completion) 시기는 오는 3월 말로 예정됐다. 톱 라인 데이터는 올해 상반기 내에 가시화될 것으로 예상된다.
이로써 APB-A1의 임상 실행 리스크가 상당 부분 해소됐다. TED는 환자 선별 기준이 까다롭고 글로벌 모집 난도가 높은 적응증으로, 임상 1상 단계에서 환자 모집이 지연되거나 중단되는 사례도 적지 않다. 해당 임상의 환자 모집을 순조롭게 마쳤다는 것은 용량제한독성(DLT)이나 중대한 안전성 이슈가 임상 진행을 가로막을 수준은 아니었음을 시사한다.
룬드벡은 2021년 10월 에이프릴바이오로부터 APB-A1을 기술 도입한 후 해당 임상을 주도해왔다. 에이프릴바이오 입장에서는 신약 개발에 따른 재무 부담을 최소화하면서 SAFA 플랫폼 기반 신약후보물질의 인체 임상 데이터를 확인할 수 있는 구조이다.
향후 데이터가 발표될 경우 관전 포인트는 △2020년 미국 식품의약국(FDA) 승인을 받은 '테페자'(Tepezza) 대비 안구돌출 감소 폭 △안전성 및 면역원성 프로파일 △약동학(PK) 특성 등이다. 앞서 APB-A1은 TED 임상 1b상 중간 결과에서 유효성 신호를 확인하며 개념검증(PoC)을 확보했다.
이번 임상 결과를 바탕으로 룬드벡이 APB-A1의 적응증 확장에 본격적으로 나설지도 주목된다. 앞서 룬드벡 관계자는 "APB-A1은 단일 질환에 그치는 것이 아니라 여러 자가면역·신경면역질환으로 확장 가능한 '파이프라인 인 어 프로덕트'(pipeline in a product)로 개발해 나갈 것"이라고 언급했다.
룬드벡은 APB-A1의 CD40L 억제제라는 차세대 기전을 바탕으로 적응증을 확장하는 전략을 적극 검토 중이다. 향후 다발성경화증(MS), 중증근무력증(gMG)등 다른 자가면역질환이나 신경면역질환으로 적응증을 확대할 가능성을 열어뒀다.
바이오업계 관계자는 "기술 이전 이후 임상이 지지부진하다 반환되는 사례도 많기 때문에 파트너사가 적응증 확장까지 언급하면서 적극적으로 임상에 나서고 있다는 것은 좋은 신호"라며 "내부적으로 물질의 기전이나 안전성에 대해 어느 정도 확신이 있는 것으로 보인다"고 말했다.
SAFA 플랫폼은 이번 임상을 통해 첫 인체 데이터가 가시화될 단계에 들어섰다. 따라서 이번 임상 결과는 APB-A1을 넘어 SAFA 플랫폼 전반에 대한 평가에 참고 지표로 활용될 가능성이 높다. 에이프릴바이오의 주요 파이프라인들은 SAFA 플랫폼을 기반으로 개발되고 있기 때문이다.
바이오업계 관계자는 "APB-A1 임상 결과에 따라 에이프릴바이오의 다른 파이프라인들의 가치에도 영향을 미칠 것"이라며 "첫 인체 데이터라는 점에서 플랫폼 리스크를 가늠하는 지표로 받아들일 가능성이 크다"고 언급했다.